检测水中藻类的方法主要有三种:
1. 藻类检测和计数新方法——置式显微镜法;
2. 改进的水中藻类检测方法;
3.藻类叶绿素及其降解产物的测定方法。
1、藻类检测和计数新方法——置式显微镜法
由于环境污染,一些湖泊富营养化程度不断加剧,导致水中藻类的快速增长。大量藻类的存在,直接影响了自来水的生产和供应。为了了解藻类对水厂各工艺环节的影响,以湖泊水为水源的许多水厂都相继开展了藻类计数检测项目。国内普遍采用的方法是将1L水样加鲁戈试剂固定在一个容器中,自然沉降24h后,利用虹吸的方法吸去上清液,并浓缩定容到30~50mL,然后取1mL放入血球计数板,在正置式显微镜下进行镜检计数[1]。此方法由于所需的水样较多(1L),在需要采集多个水样时,采集和运送的工作量大;在沉样时还要多次冲洗转移,增加了产生误差的机会,而且操作不便。昆明自来水总公司的水源之一是富化程度较高的滇池水,因而昆明水司较早开展了此项目,并得到了瑞士苏黎世供水局的技术支持和大力帮助。我们所采用的藻类计数方法的特点是使用倒置式显微镜,藻样通过沉样板一步沉降到位,与国内普遍采用的方法相比具有准确快捷,水样用量少,运送方便,无须多次冲洗转移,操作简单等优点,适用于生产和科研检测。
1.用品准备
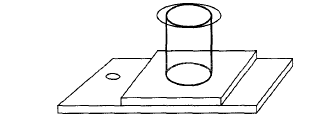
(1)沉样板。由一个长12cm,宽4.1cm,中央有圆形凹槽(底面积为5cm2)的长方形有机玻璃板和一个可滑动的、底部与凹槽形状完全吻合的空心圆筒(容积为25mL)以及一块圆形盖玻片组成(见图1),有机玻璃板的左侧有一小孔,用于放掉上清液。
(2)倒置式显微镜。与普通倒置式显微镜不同的是,它的载物台经简单改造,增加了一个长方形的金属框,大小恰好可放置沉样板。金属框的作用是将沉样板固定在载物台上,使沉样板可与载物台同步移动,避免沉样板发生偏移。两个目镜,一个装有微型刻度尺,可直接测量藻类的大小和长度,另一个装有“ ”形标尺,在讦数时用它界定讦数范围。
(3)250mL试剂瓶。用于盛装水样。
(4)移液管(1~25mL)。
2.药品准备
①鲁戈试剂(Lugols Solution);②福尔马林(40%);③洒精(50%)。
3.方法与步骤
3.1取样
先在250mL试剂中加入6~7滴鲁戈剂,再加入200mL,左右水样,摇匀。如果水样需保存较长时间,可加入适量福尔马林(40%)。
3.2沉降
用移液管取适量水样加入沉样板,再加入蒸馏水至满,加盖圆玻片,静沉24h。取多少水样,同藻类的多寡而定,藻类数量多可少取,数量少可多取,一般水样体积在1~25mL之间。
3.3计数
将沉样板上的圆筒用盖玻片推开,放掉上清液,置于显微镜上,以目镜上的“工工”形标尺为界线,随机选取若干条带计数。
一般情况是这样计数的;①在10×16倍镜头下,计数全部视野(1cm2)内的大型藻类。②在×25的倍镜下,随机选取5条带,计数基中的中型藻类。③在10×40倍的镜头下,随机选取1条带,计数其中的微型藻类。
在实际运用中,可根据当地的原水藻类情况,确定所选取的条带数。
3.4计算
式中N ——1mL;
5——沉样板板底部圆形凹槽的底面积,cm2;
S——每个计数条带的面积,cm2;
A——选取的条带数;
V——水样体积;mL;
N——实际数的A个条带的藻类个数。
将上述三个放大倍数下计数得的藻类依上式分别计算,再相加,即得到藻类总数。
3.5清洗
计数完毕,用蒸留水冲洗沉样板,浸泡于50%的酒精中过认,再次用蒸留水冲洗后,晾干待用。
4.注意事项
(1)沉样前,要将水样摇匀
(2)将沉样板的圆筒推开时,要防止产生气泡。
(3)将沉样板置于显微镜上时,要尽量保持平衡,避免藻类向一侧倾斜。
(4)在选取计条带时,既要注意随机性,又要注意均匀性。
5.实际样品检测
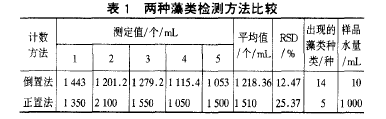
取某水厂原水用上述方法(简称倒置法)和国内普遍采用的传统方法(简称正置法)分别进行藻类检测和计数,结果见表1。
由表1可见,倒置法水样用量少,并有较高的精密度;正置法水样用量多,精密度较低,而且由于正置法使用的血球计数的容积所限(0.1m3),出现在计数框内的藻类种类也有限,如果需要分类计数,有一定局限性,不好操作。倒置法可以一边分类鉴定,一边分类计数,水样中存在的种类在1cm2的计数范围内基本都能看到,分类鉴定和计数的结果比较全面,操作也方便。另外,倒置法将水样一步沉降到位,省略了许多中间环节,减少了多次冲洗 转移带来的操作误差,从而提高了准确度。
6结论
利用倒置式显微镜进行藻类检测和计数的方法,比使用正置式显微镜的血球计数板法水样用量少,中间环节少,准确快捷,精密度较高,在分类鉴定和计数时,操作较为方便。但该方法使用的沉样板国内尚无厂家生产,需要从国外购买。
二、改进的水中藻类检测方法
水中藻类传统的测定方法是将一定量的水样加鲁哥试剂因定,在筒型分液漏斗中进行自然沉淀,48h后,借助虹吸方法吸去上层清液,按要求浓缩定容到30—50ml,然后在镜下计数,由于固定沉降时间较长,检测结果常滞后于生产和研究,影响了及时分析和解决问题。为了解决这一问题,下文对传统的检测蚊法中的沉淀浓缩进行了改进,摸索出一种快速测定藻类的方法,测定时间缩至当天即可出结果,而且准确、可靠,适用于生产和科研检测。
1测定原理
利用测大肠菌的抽滤装置,对检测水样进行抽滤,藻类被截留在滤膜(0.35—0.65μm)上,利用滤膜对藻细胞的吸附力并不强,用少量纯水在HJ-3型电磁搅拌器上萃取4、5次就能将全部的藻细胞洗回水中。
滤膜的主要成分是硝化纤维素(CN),可深于丙酮,而丙酮对藻细胞形状基本没影响,当滤膜遇到丙酮后会变成透明胶液,不影响镜下观察检测。
由于丙酮易挥发,滤膜变干会恢复原型,为了保证藻细胞和滤膜的湿度,考虑到丙酮和甘油的相容性,甘油的吸潮性及本身的油脂性,能使藻细胞和滤膜在较长的时间内保持湿润透明,因此,在丙酮溶剂中加了一定比例的甘油,但甘油太多,会影响滤膜的溶解。
2.实验方法
2.1抽滤萃取法
取适量水样,按100:1的量加鲁哥试剂固定,在装有滤膜的抽滤器上进行抽滤。取下滤膜,放到100ml的小烧杯里,有藻细胞的一面朝上,加5—8ml纯水;调好电磁搅拌器转速,使液体搅拌时不会向上溅出,将小烧杯放到搅拌器上转1mim左右,取洗液。
加入纯水5—8ml纯水;重复上步聚;振洗5次,定空洗液至50ml,在显微镜下记数,计算公工:
N=[(A/Ac)×(Vs/V·Va)]×n
式中,N为每升原水样中的浮游植物数量(个·J-1);A为计数框的体积(ml);n为计数所得藻类数目(个)。
2.2验证法
将上述实验洗净后的滤膜放入一平面皿,在空调下或热源边(不要超过40℃)使滤膜稍干燥,将滤膜放一载玻片上,加二至四滴滤膜透明液,使膜完全溶解成透明胶液,盖上盖玻片,在CHK型显微镜下观察。
此方法也可用来验证传统沉淀法中的弃液藻细胞流失情况。
3 结果及分析
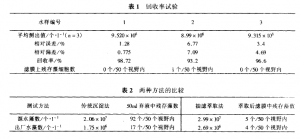
取已知数量的小球藻9.643×105·1-1,按上述方法进行回收实验,结果见表1,两种方法在实际水样中的应用结果如表2所示。
传统沉淀方法精确度低,平行样相对偏关在+15%;测试时间较长,根据理论推算,最小的藻为沉时间需要60 ,我们实验静置学时间为43H,常有一些较小的藻细胞随弃液流失,而且在南方地区气温较高,藻细胞大都偏小,易发生流失现象,流失达30%以上。
抽滤萃取法能较好地阻止藻细胞流失,但由于滤敢太小,一般只能抽滤浊度10NTU以下的水,对于源水最多只能抽滤200ML左右的水量,太多则滤孔就会被堵 而难以达到抽滤效果,所以存在取水量较少,影响代表性,如有条件,滤膜孔径可取在1.5-1.8M,对于低浊度的出厂水和滤后水,则不存在这个问题,可抽滤200-300ml水量,而且能准确地反映水中残存藻细胞的数量。
传统的沉淀方法中由于染色时间较长,藻细胞和杂质均被染成褐色,在镜下观察时,影响藻细胞的分 而抽滤萃取则没有这种问题,因为藻细胞还保存着很好的原本色泽(绝大多数为绿色)和形状,较容易与水中的细菌、真菌以及低等浮游动物、颗粒、纤维等区分开来。
3、藻类叶绿素及其降解产物的测定方法
下文综述了用分光光度法,荧光检测法及高效液相色谱法测定藻类叶绿素及其降解产物的方法. 分别详细介绍了各种方法的设备,程序,计算公式及特点.。此外,还介绍了藻类类胡萝卜素的高效液相色谱测定方法。 按测定方法分为六个部分:(1) 叶绿素a , b 和c 的分光光度法测定(三色法) ; (2) 叶绿素a 的荧光检测法; (3) 存在脱镁叶绿素a 时叶绿素a 的分光光度法测定; (4) 存在脱镁叶绿素a 时叶绿素a 的荧光法测定; (5) 高效液相色谱(HPLC) 测定藻类的叶绿素及它们的降解产物; (6) HPLC 测定藻类叶绿素及类胡萝卜素。
藻类的特异性色素是叶绿素、叶黄素和胡萝卜素. 浮游藻类里常见的三种叶绿素是叶绿素a ,b 和c.叶绿素a 在一切浮游藻类里大约占有机物干重的1~2 % ,是估计藻类生物量的好指标. 细胞的叶绿素含量随种类或类群而有所不同,同时还受年龄、生长率、光和营养条件的影响.脱镁叶绿素a (一种叶绿素a 的普通降解产物) 能够干扰叶绿素a 的测定,因为如果存在脱镁叶绿素a ,它能在叶绿素a 的相同光谱区吸收光和荧光,造成叶绿素a 值的误差. 当测定叶绿素a 的时候还要测定脱镁叶绿素a. 叶绿素a 和脱镁叶绿素a 之比可作为浮游植物生理条件的一个良好指标.下文综述了用分光光度法,荧光检测法及高效液相色谱法测定藻类叶绿素及其降解产物的方法:
(1) 叶绿素a , b 和c 的分光光度法测定(三色法) ;
(2) 叶绿素a 的荧光检测法;
(3) 存在脱镁叶绿素a时,叶绿素a 的分光光度法测定;
(4) 存在脱镁叶绿素a 时叶绿素a 的荧光法测定;
(5) 高效液相色谱测定藻类的叶绿素及它们的降解产物; (6) HPLC 测定藻类叶绿素及类胡萝卜素.
1 叶绿素a , b 和c 的分光光度法测定(三色法)
用丙酮水溶液自浮游生物浓缩样萃取色素,用分光光度计测定萃取物的吸光度. 叶绿素自细胞内提出的难度,不同藻类差异相当大. 为了将色素完全萃出,通常需要用组织研磨器机械的破坏细胞.
111 仪器和试剂
(1) 分光光度计:用窄带的(015~210nm) .
(2) 1cm ,4cm 和10cm 光程的比色池.
(3) 医用离心机.
(4) 组织研磨器(最好使用圆底的研磨管和捣杆) .
(5) 离心管:15ml ,有刻度和螺帽.
(6) 过滤设备:过滤器,滤膜(0145μm 孔径,47mm 直径) 或玻璃纤维过滤器(GFPC 或GFPA ,415cm 直径) ,真空泵.
(7)MgCO3 悬浮液:在100ml 蒸馏水中加入110g 细粉末MgCO3 .
(8) 90 %(体积比) 丙酮水溶液.
112 测定程序
(1) 离心或过滤浓缩水样. 在离心前或过滤的最后一步加入012ml MgCO3 悬浮液.
(2) 把样品置入组织研磨器,用2~3ml 90 %丙酮水溶液覆盖浸泡.
(3) 把样品移入一个有螺帽的离心管,用几毫升90 %丙酮水溶液洗研磨器,并把洗液加入到萃取液
中,用90 %丙酮水溶液调节体积到5~10ml .
(4) 在盖紧的离心管中于500g 离心20min 澄清萃取液,把澄清的萃取液倾入一支清洁的,标定过的15ml 有螺帽的离心管并测定萃取液的总体积.
(5) 把萃取液移入1cm 的比色池,在750、663、645 和630nm 测定吸光度(OD) .
113 计算
叶绿素a ,b 和c 的测定分别使用663、645 和630nm 的吸光度. 750 nm 的读数用来校正浑浊度. 将每个色素的OD 值中减去这个浑浊度校正值后,带入下列公式计算浓度:
(1) 叶绿素a (mgPl) = 11164 (OD663 ) – 2116 (OD645 ) + 0110 (OD630 )
叶绿素b (mgPl) = 20197 (OD645 ) – 3194 (OD663 ) – 3166 (OD630 )
叶绿素c (mgPl ) = 54122 (OD630 ) – 14118 (OD645 ) – 5153 (OD663 )
(2) 各单位体积色素量的计算如下:
叶绿素a (mgPm3 ) = 叶绿素a (mgPl ) ×萃取液的总体积(l) / 水样体积(m3 )
2 叶绿素a 的荧光检测法
叶绿素a 的荧光检测法比分光光度法灵敏,需样品较少. 而且不要求像分光光度法那样的波长分辨率,在430nm 的激发波长和在663nm 的发射波长抽取在试管内测定叶绿素a 可过的最佳灵感度.
211 仪器和试剂
(1) 荧光计,备有高强度F4 T. 5 蓝光灯,光电倍增管R – 136 (红敏) ,可滑动窗孔,光发射(CS – 2 – 64)
和光激发(CS – 5 – 60) 滤光片,以及一个高灵敏度门.
(2) 其他设备和试剂同111
212 测定程序
(1) 用已知浓度的叶绿素溶液标定荧光计:
用分光光度法测定浓度约为2、6、20 和60μgPl 的叶绿素a 萃取液,再在每一灵敏度位置对每一溶液进行读数,导出标定系数Fs
Fs = CaPRs
式中 Fs ———灵敏度位置S 的标定系数
Rs ———灵敏度位置S 的荧光计读数
Ca ———分光光度法测定的叶绿素a 浓度(μgPl)
(2) 在能够取得适中读数的各灵敏度位置测定样品的荧光,将读数乘以适当的标定系数,得到叶绿素a 浓度..
3 存在脱镁叶绿素a 时叶绿素a 的分光光度法测定
由于脱镁叶绿素在接近叶绿素a 相同的波长上有吸收,因而含有脱镁叶绿素时叶绿素a 的测定值可能偏高. 叶绿素a 由于酸化作用变成脱镁叶绿素a ,吸收峰的值比原来大约降低40 % ,并从663nm 移至665nm ,酸化前后产生的吸收峰之比为1170 ,可用来表观叶绿素a 的浓度作脱镁叶绿素a 的校正.
311 仪器和试剂
(1) 同111
(2) HCl 1mol·L – 1
312 测定程序
(1) 用90 %丙酮水溶液萃取色素,离心澄清,在750、663nm 读取OD 值.
(2) 在1cm 的比色池中用两滴1mol·L – 1 HCl 酸化萃取液,轻轻搅拌1~2min 后在750、665nm 读取OD 值.
(3) 酸化前OD663和酸化后OD665值都减去OD750值.
313 计算
使用校正过的值计算叶绿素a 浓度(C) 与脱镁叶绿素a 浓度(P)
C(mgPm3 ) = 26173 (663b – 665a)V1PV2L
P(mgPm3 ) = 26173[117 (665a) – 663b ]V1PV2L
式中V1 ———萃取液的体积(l)
V2 ———水样的体积(m3 )
L ———比色皿液层厚度(cm)
663b ,665a 分别为酸化前后90 %丙酮水溶液萃取的吸光度.
26173 是吸光度校正
4 存在脱镁叶绿素a 时叶绿素a 的荧光法测定
用荧光法测定脱镁叶绿素a 的浓度,需要测定酸化前后丙酮萃取液的荧光. 叶绿素a 由于酸化后变成脱镁叶绿素a ,致使荧光降低,利用这一原理进行测定萃取液的脱镁叶绿素a 浓度.
411 仪器和试剂
(1) 同21a
(2) HCl 1mol·L – 1
(3) 纯叶绿素a
412 测定程序
校准荧光计,在每一灵敏度位置测定酸化前后萃取液的荧光. 计算校准系数(Fs ) ,用酸化前的荧光读数除以酸化后的荧光读数,算出酸化前后的荧光比.
413 计算
叶绿素a (mgPm3 ) = Fs (Rb – Ra) rP(r – 1)
脱镁叶绿素a (mgPm3 ) = Fs (rRa – Rb) rP(r – 1)
式中 Fs ———灵敏度位置S 的换算系数
Rb ———萃取液酸化前的荧光
Ra ———萃取液酸化后的荧光
r ———RbPRa
5 高效液相色谱测定藻类的叶绿素及它们的降解产物
511 仪器和试剂
除色素提取物外还包括:
(1) 高效液相色谱仪,流速为210mlPm.
(2) 装有100 微升进样环管的高压进样阀.
(3) 保护柱(410 3 015cm , C18 , 3μm)
(4) 反相HPLC 柱(C18 , 10cm , 3μm)
(5) 荧光检测器,波长为430 ±30nm ,可发射超过600nm 荧光.
(6) 数据纪录装置,长条纸记录器或电子积分仪.
(7) 注射器,玻璃,250μL
(8) HPLC 洗脱剂:洗脱剂A(80∶15∶5 ;甲醇∶Ⅰ型试剂∶离子对溶液) ,洗脱剂B(80∶20 ;甲醇∶丙酮) .
(9) 校准标准物:分别将1ml 纯叶绿素a 和b 溶于100ml 90 %丙酮中,用分光光度法测定其准确浓度. 用上述叶绿素a 和b 标准物经盐酸酸化后制得脱镁叶绿素a + a′和b + b′标准物;从硅藻中萃取叶绿素c 和脱植基叶绿素a ,酸化脱植基叶绿素a 制得脱镁叶绿素酸a ,分别用薄层色谱法(TLC) 纯化,分光光度法校准,作为标准物.
512 测定程序
(1) 用洗脱剂A ,流速为210mlPm ,建立和平衡HPLC 系统;校准荧光计的感光度,用叶绿素a 标样的浓度最大值作为满刻度.
(2) 通过先前制备的标准物校准HPLC 系统的工作标准. 分别混合叶绿素与脱植基叶绿素a ,脱镁叶绿素a 和脱镁叶绿素酸a ,作为混合标准物. 混合1ml 标准液与300μL 离子对溶液,平衡5 分钟后进样. 混合1ml 90 %丙酮与300μL 离子对溶液作为空白液. 用150μL 标准液漂洗注射器2 次,注射器中吸入250μL 标准液用于进样,将注射器插入进样阀,充满100μL 的进样环管. 建立标准色素浓度与荧光峰面积(或高) 的标准曲线.
(3) 混合1ml 90 %丙酮色素提取物与300μL 离子对溶液,作为进样样品.
(4) 使用两步溶剂程序,用于优化叶绿素及其降解产物的分离. 进样后,5 分钟内将洗脱剂A 转变为洗脱剂B ,维持B15 分钟,流速为210mlPm. 在下一次进样前,需用洗脱剂A 重新平衡色谱柱5 分钟. 总分析时间约为25 分钟.
(5) 用下列公式计算各色素的浓度
Ci = AsFiVe
PVEVs
式中 Ci = 各色素的浓度mgPl
As = 各次进样的色素峰面积
Fi = 标准响应因子
Ve = 进样体积(011ml)
VE = 萃取体积(ml)
Vs = 样品体积(l)
(6) 这种方法仅用于叶绿素及其降解产物的定量.
(7) 检测限随荧光计结构与流速而变,但对于大多数叶绿素与它们的降解产物来说,每次进样检测限范围在10~100pg. HPLC 法的精确度主要取决于色素标准样的纯度. 更理想的方法是测定标准样的吸收光谱(350~750nm) 并与文献数据相比较. 色素的纯度也可用HPLC 法来测定,条件是不存在能与标准物的吸收和荧光谱带相重叠的共洗脱污染物. 如果分光光度法测得的数据经脱镁色素校正,HPLC 的结
果表达为色素当量(例如:叶绿素a 当量= 脱植基叶绿素a + 叶绿素a + 叶绿素a′,假定使用正确的分子量校正值) ,那么HPLC 法与分光光度法提供的色素浓度与提供的EPA 标准符合得很好. 因此如果明显的存在色素衍生物,用分光光度法测得的数据会偏高. 要HPLC 法与荧光法测得的数据一致则取决于附加的叶绿素b ,c 和它们的衍生物.
6 HPLC 测定藻类叶绿素及类胡萝卜素
611 仪器和试剂
除色素提取物外还包括:
(1) 高效液相色谱泵,可进行三种不同溶剂的梯度输出,流速为110mlPm.
(2) 装有200 微升进样环管的高压进样阀.
(3) 保护柱. (50 3 416mm ,C18 ,5μm)
(4) 封尾的反相色谱柱(250 3 416mm ,5μm ,C18 ) .
(5) 可变波长或过滤吸光度检测器,带有低体积流通池,检测波长为436nm.
(6) 数据纪录装置.
(7) 注射器,玻璃,500μL
(8) HPLC 洗脱剂:洗脱剂A(80∶20 ; 甲醇∶015M乙酸铵,pH 712) ,洗脱剂B(90∶10 ;乙腈∶水) ,洗脱剂C(乙酸乙酯) .
(9) 校准标准物:叶绿素a 和b ,β,β2胡萝卜素可购买. 其他色素标准物可用TLC 或制备级HPLC 从植物提取物种纯化得到. 在校准HPLC 系统前,在专用溶剂中使用装有单色器的分光光度计测定所有标准物的浓度. 使用公式:
Ci = 1000 (Aλmax- A750nm)PE1cmb
式中 Ci = 各色素的浓度mgPl
A = 特定波长下的吸光度
E = 吸光系数lPgcm
b = 比色池长度cm
612 测定程序
(1) 用洗脱剂A ,流速为110 mlPm ,建立和平衡HPLC 系统;
(2) 通过先前制备的标准物校准HPLC 系统的工作标准. 混合1ml 标准物与300μL 蒸馏水,摇动,平衡5 分钟后进样. 用300μL 标准液漂洗注射器2 次,注射器中吸入500μL 标准液用于进样,将注射器插入进样阀,充满200μL 的进样环管. 混合1ml 90 %丙酮与300μL 蒸馏水作为空白液. 建立标准色素浓度与荧光峰面积(或高) 的标准曲线.
(3) 混合1ml90 %丙酮色素提取物与300μL 蒸馏水,作为进样样品.
(4) 样品进样采用梯度程序用以优化叶绿素及类胡萝卜素的分离.
(5) 通过比较样品峰与纯标准物峰的保留时间来定性.
(6) 浓度的计算方法同512. (5)
(7) 这种方法为叶绿素与类胡萝卜素的分离而设计,同时也可以分离主要的叶绿素分解产物. 方法的精确度由测定三倍进样的浮游植物群落和植物的提取物确定. 使用合适的内标物可提高精确度.