近日,浙江大学周民团队设计了一种可高效负载ASX的微藻-纳米复合口服递送系统,用于防护肠道及全身的放射性损伤(图1),该项工作以Oral Microalgae-Nano Integrated System against Radiation-Induced Injury为题发表于ACS Nano。该工作以课题组前期的微藻递送研究为基础,采用可食用的天然微藻—螺旋藻(Spirulina platensis, SP)作为复合递送系统的微载体。由于SP表面具有负电性,因此可以吸附正电荷物质。团队利用了SP的这一天然特性,首先将ASX封装于壳聚糖修饰的正电荷纳米颗粒(ASXnano)中,再使其通过静电吸附作用附着于SP表面,形成均匀致密的纳米涂层,从而构建了将微藻载体与纳米载体相结合的复合递送系统(SP@ASXnano),该合成方法步骤简易、负载效率高,可有效保持SP与ASX的结构与生物活性。
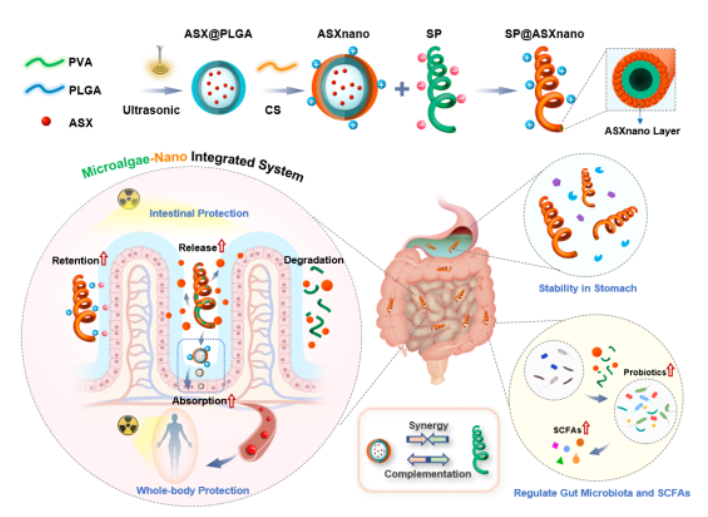
图1 微藻-纳米复合口服递送系统的合成步骤与主要作用机制。PVA,聚乙烯醇;PLGA,聚乳酸-羟基乙酸;ASX,虾青素;CS,壳聚糖;SP,螺旋藻;ROS,活性氧;SCFAs,短链脂肪酸
实验显示,所构建的微藻-纳米复合递送系统具有“既互补又协同”的作用特性,SP与ASXnano之间既具有互为补充的药物递送能力,又具有多方面的协同治疗作用。具体而言,SP微载体具有肠内滞留时间长、分布面积大、易于降解等递送特点,可在肠道内持续、充分地释放ASXnano;ASXnano纳米载体则可以提高药物水溶性,保护药物活性,促进药物经肠道吸收进入血液循环,从而有效增加肠道与全身的药物浓度,显著改善口服生物利用度。同时,SP和ASXnano在抗炎、保护造血功能、调节肠道菌群、增加粪便SCFAs等方面具有协同效应,可共同增强对放射性损伤的防护效果,发挥多方面的有益作用。
该工作利用天然微藻有效负载了难溶性药物虾青素,实现了该药物在肠道与全身辐射防护中的口服应用,开发了一种具有良好安全性、口服利用度与多重有益效果的口服辐射防护制剂。该研究也揭示了微藻-纳米复合策略在口服递送中的优势,拓展了螺旋藻作为难溶性药物载体的适用性,为口服药物递送和辐射防护研究提供了有潜力的解决方案。