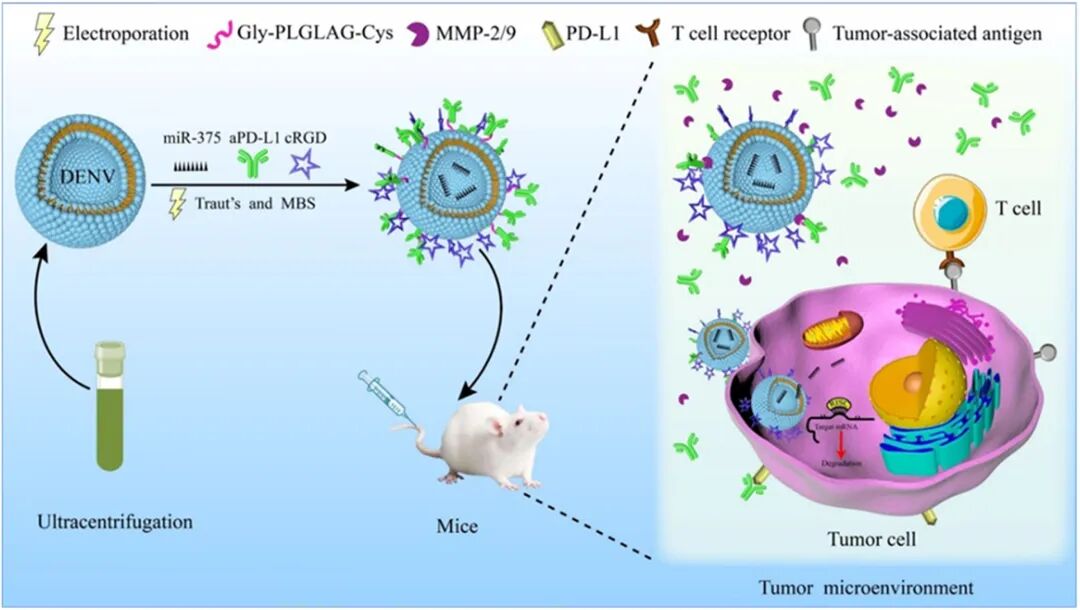
食管癌作为常见的消化系统恶性肿瘤,在现有治疗手段下仍面临疗效有限和预后不良等挑战。近年来,外泌体因其良好的生物相容性与低免疫原性,成为药物递送领域的研究热点,但其规模化制备及成分可控性仍是亟待突破的瓶颈。为此,本研究构建了一种基于天然海洋单细胞来源的类外泌体纳米囊泡靶向递送系统,旨在实现基因治疗与免疫治疗的协同增效。
该系统以杜氏盐藻(Dunaliella salina)提取的纳米囊泡(DENV)为载体,通过表面修饰c(RGDyK)靶向肽,使其能够特异性识别食管癌细胞表面整合素,增强肿瘤部位的富集能力并降低非特异性摄取。进一步采用电穿孔技术将具有抑癌功能的miR-375高效载入囊泡内部,同时在囊泡表面通过MMP-2敏感多肽连接抗PD-L1抗体(aPD-L1),构建出兼具靶向、免疫调节与基因调控功能的工程化复合体系。该cRGD-DENV-aPDL1/miR375粒径分布均匀(约150 nm),并在肿瘤微环境中高表达的MMP-2/9作用下可实现aPD-L1的响应性释放,具备良好的缓释特性。
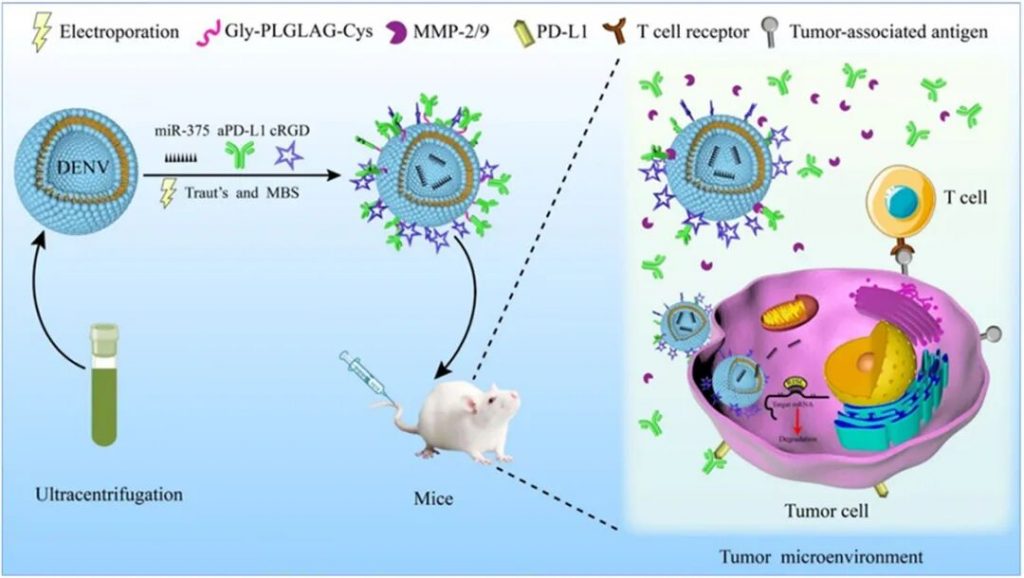
体外实验表明,该靶向递送系统能有效促进药物进入肿瘤细胞,显著抑制肿瘤细胞的生长、迁移和侵袭。在动物模型中,cRGD-DENV-aPDL1/miR375显示出优异的肿瘤靶向积累能力和抑制肿瘤生长的效果。其作用机制与调控下游靶基因YWHAZ的表达密切相关,从而同时影响肿瘤增殖、免疫逃逸等多条信号通路,实现基因-免疫联合治疗的协同增强。
本研究不仅证实了杜氏盐藻来源的类外泌体纳米囊泡作为一种高效、安全的药物递送平台的可行性,更探索了其在协同递送基因药物与免疫制剂方面的应用潜力。该体系原料来源广泛、制备简便、易于功能化修饰,为大规模、低成本生产性能稳定的类外泌体纳米药物提供了新思路,也为食管癌等恶性肿瘤的联合治疗策略开发提供了实验依据。
原文链接:Artificial pancreas with engineered β cell microspheres overexpressing PD-L1 and algae ameliorate type 1 diabetes