光合作用是地球上规模最大、最重要的化学反应。光合生物利用太阳能合成有机物,释放出氧气,为人类繁衍和社会发展提供基本的物质基础和能量来源【1】。历经漫长的地质变迁和适应进化过程,光合生物重新塑造了地球表面和大气层成分,也演化出了千姿百态的生命形态。最为人所熟悉的就是陆地上各种各样的绿色植物,而海洋光合生物也贡献了地球上每年原初生产力的一半左右,与陆地植物相当。其中,硅藻(Diatoms)贡献了地球上每年约20%的原初生产力(吸收二氧化碳的能力占全球生态系统的五分之一左右)【2】,比热带雨林的贡献还要高,因此在地球的元素(碳、氮、氧、硅等)循环和气候变化中发挥着重要作用【3】。
硅藻(wikipedia.org/wiki/Diatom)
硅藻可能起源于红藻的二次内共生事件,是现代海洋最“成功”的浮游光合生物之一,也是是海洋赤潮的主要类群之一。硅藻具有很强的适应能力,种类繁多,在海洋中从赤道到两极都有分布,甚至在淡水、土壤和空气中都可以生存。那么硅藻为何会如此“成功”呢?先前的研究表明,精致的硅纳米结构的细胞壁、紧密的线粒体和叶绿体能量偶联、奇特的氮素代谢能力、强大高效的光合作用能力是硅藻能够在海洋中繁盛的重要原因。硅藻捕光天线蛋白“岩藻黄素-叶绿素a/c蛋白复合体”(Fucoxanthin chlorophyll a/c protein,FCP)具有出色的蓝绿光捕获能力和极强的光保护能力,是硅藻细胞快速生长和繁殖的能量基础【4,5】。然而,硅藻光合膜蛋白的结构长期没有得到解析,极大限制了硅藻光合作用的研究。
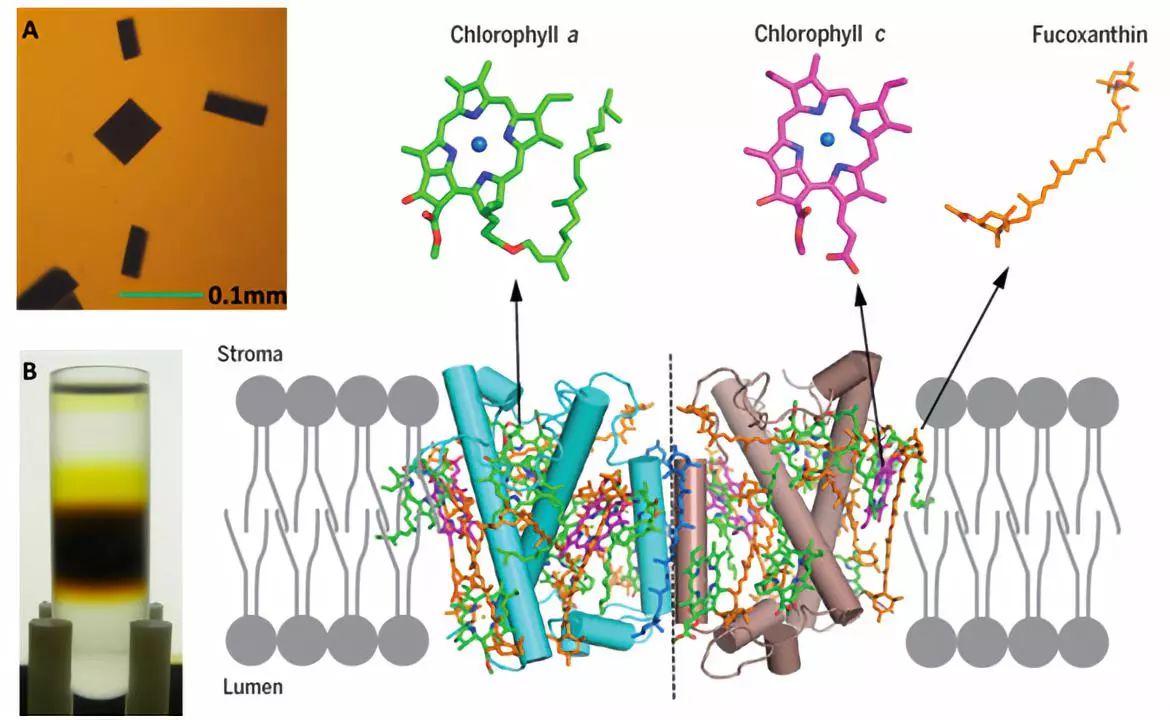
图1:三角褐指藻类囊体膜上的 FCP 二聚体晶体结构。A和B:FCP 蛋白和晶体;蛋白中的叶绿素a(绿色),叶绿素c(洋红色),岩藻黄素(橙色)和硅甲藻黄素(蓝色)分子结构分别以棍状图显示。
2019年2月8日,国际著名学术期刊 Science 在线发表了中国科学院植物研究所沈建仁和匡廷云研究团队题为Structural basis for blue-green light harvesting and energy dissipation in diatoms 的研究长文(Article),报道了硅藻捕光天线蛋白 (FCP) 捕获蓝绿光和淬灭过剩激发能的结构基础。这是硅藻的第一个光合膜蛋白结构解析研究工作(图1和2),也是中国科学院植物研究所继高等植物和红藻重要光合膜蛋白的结构与功能研究之后【6-8】,在海洋重要光合生物膜蛋白结构与功能研究领域取得的又一重要突破。
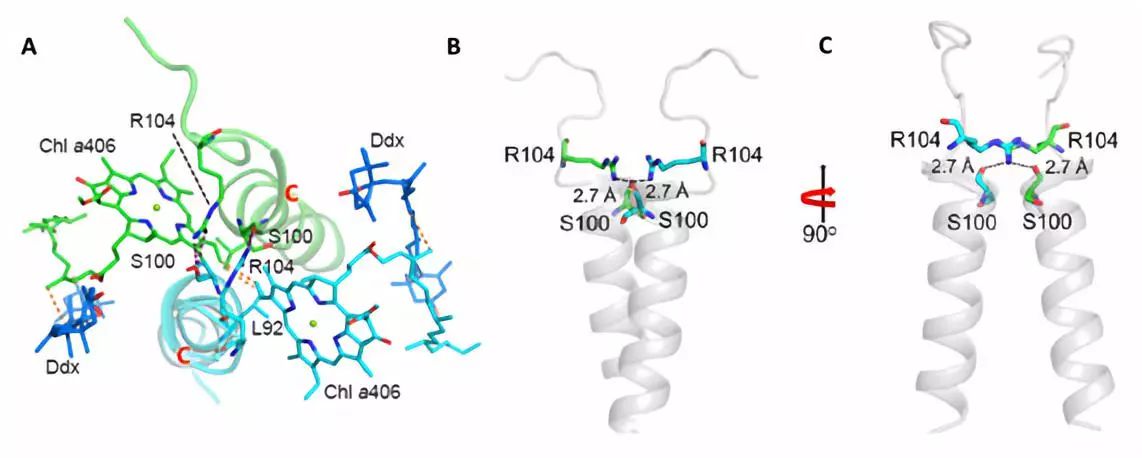
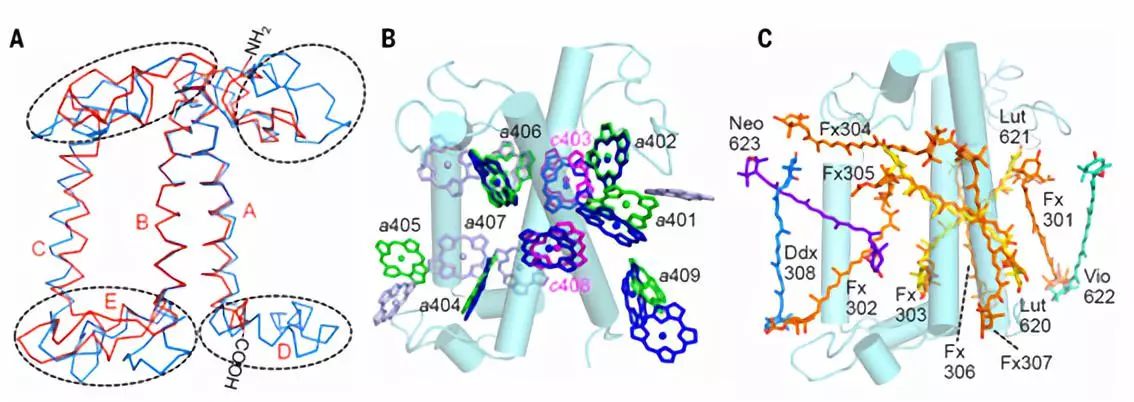
硅藻的FCP复合体属于捕光天线复合物超级蛋白家族,但其氨基酸序列与高等植物和绿藻的叶绿素a/b捕光天线蛋白(LHC蛋白)的序列同源性很低【6】,特别是在N和C末端差异很大(图3A)。尤其是 HelixD 和一些关键氨基酸丢失,导致 FCP 以同质二聚体的方式聚合,而不是多年以来预测的三聚体模型。FCP 依赖类囊体膜基质侧表面的氢键和膜内的两个叶绿素以及一对 Helices C 形成的强力疏水作用形成二聚体(图2)。
图2:FCP二聚体结合方式。A:叶绿素(Chl)a406和Helices C形成的大范围疏水作用;B和C:类囊体膜表面的R104和S100侧链形成一对氢键
FCP 结合大量岩藻黄素和叶绿素c,可捕获蓝绿光,以适应深水下弱光环境,也使得硅藻细胞呈现红褐色。研究人员通过结构解析发现,每个 FCP 单体中结合7个叶绿素a,7个岩藻黄素,2个叶绿素c,1个硅甲藻黄素和一些脂类及去垢剂分子(图1和图3)。每个 FCP 单体结合的叶绿素数量少于 LHCII 复合体中的14个叶绿素(图3B)。2个叶绿素c都结合在叶绿素a和岩藻黄素形成的特征性口袋结构中,每个叶绿素c分子分别与2个叶绿素a分子成簇,并与其中1个叶绿素a分子紧密耦合;每个叶绿素簇内的叶绿素距离都在3.5Å左右(图4),可以使能量快速高效地传递。 FCP 二聚体内部的叶绿素距离都在10Å之内,使激发能达到快速的平衡和传递。
图3:FCP 和 LHCII 结构对比。A:Lhcf4 和 Lhcb1 的二级结构差异;B:FCP结合的叶绿素a(绿色)和叶绿素c(洋红色),LHCII 中的叶绿素a/b分别用蓝色和银色显示。C:类胡萝卜素结合位点对比。硅甲藻黄素:Ddx;叶黄素:Lut;紫黄质:Vio;新黄质:Neo。
图4: FCP 单体中的叶绿素c和岩藻黄素结合位点。A:对称分布的叶绿素c和岩藻黄素及其结合的氨基酸侧链。B和C:叶绿素簇与岩藻黄素分子的空间关系。
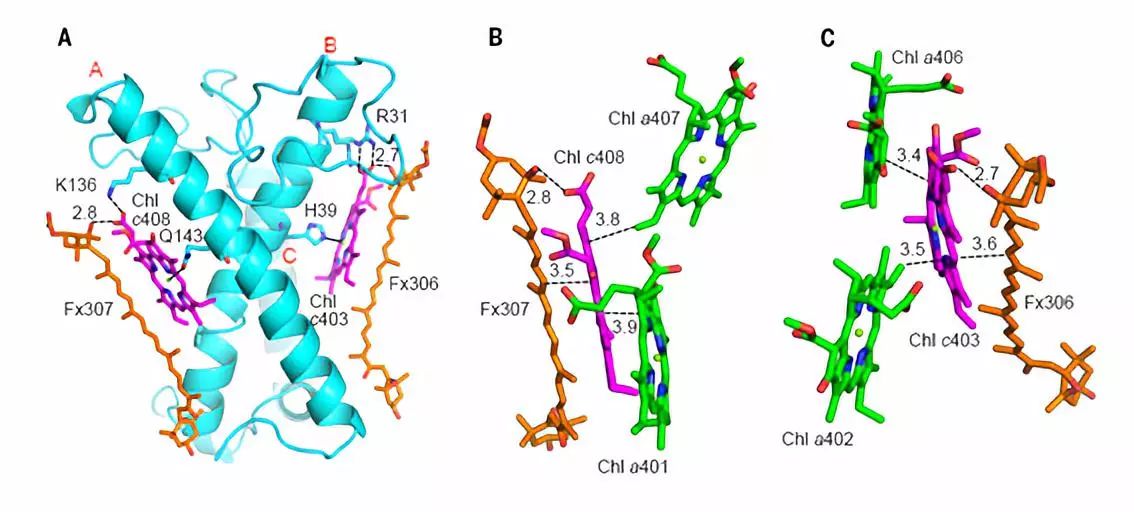
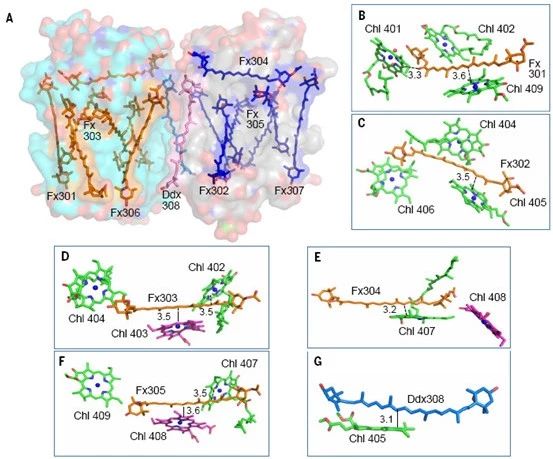
岩藻黄素是具有共轭羰基的类胡萝卜素,具有很强的溶剂效应,其结合的极性的蛋白环境是捕获绿光的结构基础。在每个 FCP 单体中,6个岩藻黄素分子插入到光合膜内,另1个新型的岩藻黄素分子水平结合在膜表面,这拓展了类胡萝卜素在捕光天线蛋白中的结合方式和绿光捕获能力。其中 Fx303 和 Fx305 与高等植物的 Lutein 相似(图3C),结合在完全疏水的膜内蛋白环境中,以此推测其吸收光谱红移最少,主要捕光蓝绿光(460-500 nm)。结合在叶绿素c丙烯酸尾部的 Fx306 和 Fx307 的两个末端基团都暴露在极性环境下,导致它们的吸收光谱红移至 500-550 nm,可以帮助硅藻捕获并利用绿光。平躺的 Fx304 也将两个末端基团都暴露在膜表面,也是可以捕获绿光的岩藻黄素分子。而 Fx301 和 Fx302 只有一个末端基团暴露在类囊体膜囊腔侧(图5A),捕获绿光的能力介于前两类之间。
所有岩藻黄素与叶绿素距离都在 4 Å之内,形成共轭系统的偶联,使其捕获的光能可以高效地向叶绿素传递,同时也可能使岩藻黄素作为光保护的有效分子(图5 B-F)。硅甲藻黄素分子与 FCP 蛋白结合较弱,可能是与周围的膜脂分子相关,以便于参加到硅藻的类胡萝卜素循环中,进而使得硅藻适应从水下到水面的快速剧烈的光环境变化(图1和图5)。
图5 岩藻黄素和硅甲藻黄素在 FCP 二聚体中的蛋白结合环境(A)以及与叶绿素之间的空间关系(B-G)。
该高分辨率的 FCP 晶体结构首次描绘了叶绿素c和岩藻黄素在光合膜蛋白中的结合细节,阐明了叶绿素和岩藻黄素在 FCP 复合体中的空间排布,揭示了叶绿素c和岩藻黄素捕获蓝绿光并高效传递能量的结构基础;首次揭示了 FCP 二聚体的结合方式,对几十年来硅藻主要捕光天线蛋白聚合状态研究提供了第一个明确的实验证据。这一研究工作为揭示光合作用光反应拓展捕光截面和高效捕获传递光能机理,以及硅藻超强的光保护机制提供了坚实的结构基础;为实现光合作用宽幅捕获和快速传递光能的理论计算提供了可能,为人工模拟光合作用机理提供了新理论依据。也为指导设计新型作物、提高植物的捕光和光保护效率提供了新思路和新策略。
匡廷云院士与沈建仁研究员为该论文的通讯作者,王文达博士和于龙江博士为本文共同第一作者。本项目得到日本冈山大学的合作研究支持,也得到了上海光源同步辐射光源、日本 SPring8 和 KEK 同步辐射光源、以及瑞士 SLS 同步辐射光源的技术支持;中国科技部国家蛋白质重点研发计划、中组部人才支持项目、中国科学院先导专项、中国科学院前沿重点项目和院长基金提供了经费资助。
据了解,该论文最初投稿的类型为report,Science 编辑部和四位 Reviewers 都对该高分辨率的海洋硅藻捕光天线蛋白工作给予了高度评价,认为这是非常出色和有科学意义的工作,是相关研究领域期待已久的结构解析工作,并建议投稿的Report版本拓展为Article形式发表。
论文原文链接:
http://science.sciencemag.org/content/363/6427/eaav0365
参考文献:
- R. Croce, H. van Amerongen. Natural strategies for photosynthetic light harvesting. Nat. Chem. Bio. 10, 492-501 (2014).
- F. G. Falkowski, M. E. Katz, A. H. Knoll, A. Quigg, J. A. Raven, O. Schofield, F. J. Taylor. The evolution of modern eukaryotic phytoplankton. Science 305, 354-360 (2004).
- A. Falciatore, C. Bowler. Revealing the molecular secrets of marine diatoms. Annu. Rev. Plant Bio. 53, 109-130 (2002).
- C. Büchel. Evolution and function of light harvesting proteins. J. Plant Physiol. 172, 62–75 (2015).
- R. Goss, B. Lepetit. Biodiversity of NPQ. J. Plant Physiol. 172, 13-32 (2015).
- Z. F. Liu, H. C. Yan, K. B. Wang, T. Y. Kuang, J. P. Zhang, L. L. Gui, X. M. An, W. R. Chang. Crystal structure of spinach major light-harvesting complex at 2.72 angstrom resolution. Nature 428, 287-292 (2004).
- X. C. Qin, M. Suga, T. Y. Kuang, J. -R. Shen. Structural basis for energy transfer pathways in the plant PSI-LHCI supercomplex. Science 348, 989-995 (2015).
- X. Pi, L. Tian, H. E. Dai, X. Qin, L. Cheng, T. Kuang, S. F. Sui, J. R. Shen. Unique organization of photosystem I-light-harvesting supercomplex revealed by cryo-EM from a red alga. Proc. Nat. Acad. Sci. USA, 115, 4423-4428 (2018).
本文转自:BAP BioArt植物