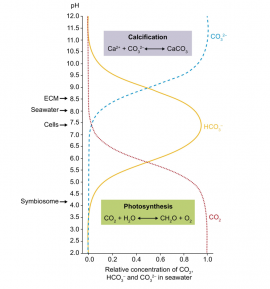
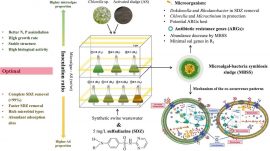
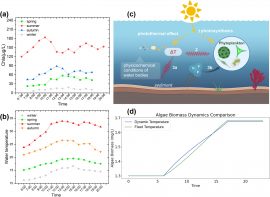
1.1藻种的采集
实验室用藻种一是到国家法定机构采购,二是购买商业派生藻种,三是科研中藻种交流。不管是哪种来源,均统一采集。采集中严格按照规范执行。要求包装可靠,采集迅速,不泄漏不污染。保证藻种合格和环境安全。采集中要有藻种传代标识。选择有资质的标准藻株的合格供应商,每批标准藻株必须附带有供应商的合格证或检测报告或说明书,来证明所采购的标准藻株是合格的。
1.2标准藻株和验收
实验室收到标准藻株,首先应进行符合性感官检查,记录藻株号和标准藻株来源途径信息,确保溯源性清楚。同时还应记录标准藻株名称和数量、生产日期、接收日期和有无破损等情况。
1.3冻干标准藻株的复活
1.3.1开启产品包装:先用70%酒精棉擦拭外包装,再打开使用。
1.3.2复活:选择合适的培养基和培养条件(根据藻种使用说明书,见附录)进行复活。藻种的首次活化最好是在非选择性琼脂培养基上,除非特殊情况或特别推荐,一般不用液体培养基。冻干藻株的传代次数不得超过5代,从标准藻株保藏中心购买的冻干标准藻株为第F0代。
注:培养基后面的数字编号为产品编号,如需采购,请联系经销商或业务员。上表提供了藻种传代短期保存的方法,供参考。
1.4工作藻株确认方法及依据
用无藻接种环取上述培养物,在相应的培养基平板(营养琼脂、大豆胰蛋白胨琼脂)上或相应的细藻鉴别平板(如伊红美蓝、麦康凯、BP等上划线分离单个藻落,置适宜条件下培养(若该类微生物为厌氧藻,则培养条件应为厌氧条件)。以同样方法取真藻和酵母藻至SDA(萨布罗培养基)平板上或玫瑰红钠培养基平板上,23~28℃下培养7d;培养后观察是否具有典型的藻落状态,然后挑取单一纯藻落,进行革兰染色、镜检,观察其染色特征及藻体形态以确定藻种。
1.5 污染处理
假如在该平板上发现有其他藻落生长,则说明操作有污染或藻种不纯。要将
该污染培养物做灭藻处理,寻找原因,重新分离挑选纯藻落。
1.6藻种保存
所有藻种均由实验室专人(双人双锁)保存于专用冰箱或其它保存方式。要建立藻种登记台帐,详细记录藻种采集、保管、制备、使用、处置情况;每一种藻种一定要有检测鉴定报告(具体的的鉴定方法见藻种质量报告鉴定证书上的方法);
具体藻种固体保存方法一般为:
将培养基与灭菌甘油按15%甘油比例(肉汤8.5mL+甘油1.5mL)混合,-30 ℃冻存,(可用2mL冻存管冻存多管),作为保藏储备藻株F1代,也可使用商品化的藻种保存管。
1.7藻种的传代
1.7.1标准藻株的复苏:
① 藻种操作应在无藻条件下进行,防止杂藻污染。
② 每次使用和复苏时只需将小珠在平板上滚动或置肉汤中培养。
1.7.2标准储备藻株每转接一次须进行确认。(确认方法一般为他们各自独有的形态,在鉴别培养基上的形态)
1.7.3工作藻株转接的方法:
①、配制营养琼脂培养基,121℃高压灭藻15分钟后分装在试管内,冷却后备用。
②、在无菌条件下,用接种环挑取藻苔至新鲜试管上作“米”字形划线接种,放置在36℃的培养箱内培养24小时。
1.7.4工作藻株的使用
1.7.4.1内部质量控制:一个月一次阳性对照、培养基每批验收;
1.7.4.2外部质量控制:能力验证、实验室比对;
1.7.5工作藻株的期间核查
1.7.5.1期间核查的频率:每半年对使用标准藻株进行一次期间核查。
1.7.5.2工作藻株期间核查的方法及依据:同工作藻株的确认一样。
1.7.5.3建立标准藻株期间核查记录。
1.8藻种的标识和使用期限:
1.8.1标识:藻种代数的计算为干粉藻种为第0代,转接一次加一代。具体标识为:例小球藻第0代,标识为CL-0,第一代标识为CL-01第一代有12支,则CL-01-01、……、CL-01-12;并标明日期:如2016.02.13这样填写。
1.9 藻种的保藏
1.9.1将试管内藻种放入冰箱中2~8℃冷藏保存。
1.9.2将传代并经过培养后的藻种放入冰箱中2~8℃保存。每支保存藻种需标明藻名、标准编号、传次、传代日期。
1.10藻种的销毁
1.10.1藻种使用后或超过贮存期的应进行销毁。
1.10.2需销毁的藻种,应用高压蒸汽(121℃)灭藻30分钟。
1.10.3灭藻后,再进行清洗和处理。
1.10.4销毁的藻种应做好记录。销毁时由化验负责人监督销毁,保管人员负责销毁。