微型单细胞藻类的分离和培养方法基本上与菌类的方法相似,但还需加上光照条件,并以液体培养为主。在大量培养时,可不必考虑无菌条件。
上海光语生物科技有限公司提供的光生物反应器可以用来实验室培养藻类。
一、目的
学习藻类的分离和培养方法
二、药品、材料和用具
水生生物培养槽,玻璃片(面积稍大于培养槽),橡皮管,显微镜,三角烧瓶,试管,筛绢,棉塞,微吸管,凹玻片,灭菌锅,载玻片,吸管,培养皿,人工光源,木盆(或小型实验池),充二氧化碳气钢瓶,抽气泵,离心机。
土壤抽出液,青霉素,链霉素,琼脂,硝酸钙,磷酸二氢钾,磷酸氢二钾,过磷酸钙,硫酸镁,氯化钾,碳酸钠,三氯化铁,硅酸钠,葡萄糖,蛋白胨,硫酸铵,硝酸铵,氯化钙,碳酸氢钠,钼酸,氯化钠,柠檬酸铁,硫酸锰,人尿,海泥抽出液,食盐。
三、操作
生长在静水或水流缓慢河流中的藻类,培养比较容易。取到实验室后,要立刻从材料瓶中移到宽大的水生生物培养槽内。为了培养大的丝状藻,要利用宽的、不高的容器。这些容器要用玻片盖住,以防止培养物受灰尘沾污。倒入容器的水要达到容器高度的一半,或稍多些,使水面上还有充分空气。在容器边缘,要用一小块纵切橡皮管垫住,可使玻片不致紧贴容器,空气才能进入容器中。细微的藻类如团藻目、硅藻门能很好地生活于培养皿中。很多藻类如颤藻属、水绵属的若干种、轮藻属等可在实验室中保存很多年。
在迅速流动水中生长的藻如丝藻属、毛枝藻属等比较难于培养,因为它们要求经常输入氧气。在水层较高水中,在高容器中,这些藻类迅速地死亡。为了把这些藻类保存到实验时,应当把它们分成一些小部分,放在水层较薄的、宽的容器内,并须常常换水,把空气吹入水中。还可以用橡皮管把水生生物培养槽和水龙头连结起来,建立有流水的水生生物培养槽。
在水生生物培养槽中培养藻类时,应尽可能创造和保持藻类天然生存条件。把藻类培养在从采集藻类那一水域取来的水中,或其他天然水(尤其不能用自来水,因其中含很多氯气,必要的话,也须置较长时间,或加以煮开),或在水中加入混合养料,这些养料是由制造有机物质所必需的矿质盐构成。
在夏季,不要把藻类培养物放在直射太阳光下,而要放在凉爽的场所,例如向北窗台上。在秋、冬季节,如希望藻类保持积极生活活动状态,就要把培养物移到有人工光照处。
以上是一般藻类粗放的培养、保存方法。如要作较深入实验,需注意以下问题:
1.藻种的分离
藻类培养首先要有藻种。从天然水域的混杂生物群中,用一定方法把所需藻类个体分离出来,而获纯种培养。这种方法称为藻种分离和纯化,又称纯培养法。
真正的“纯种培养”是指在排除包括细菌在内的一切生物的条件下进行的培养。这是进行科学研究不可缺少的技术,而在生产性培养中不排除细菌的称之为“单种培养”。
(1)采样和预备培养:首先要采集有需要分离藻类的水样,采回后在显微镜下检查。如发现需要分离的藻类数量较多时,可立即分离。若数量很少,最好先进行预备培养,待其增多后,再分离。
用作预备培养的培养液,各种藻类是不同的,对一些难以培养的藻类一般加入土壤抽出液较好。预备培养液营养成分浓度应小些,一般只有原配方的1/4~1/2。如水样中藻类种类较多,就应使用几种不同的培养液,使藻类在适合于自己繁殖的培养液中繁殖起来。
可用三角烧瓶或试管作培养容器,加入容量1/4~1/3培养液。然后把经筛绢过滤除去大型浮游生物的水样接种进去,放在合适温度下或室内靠北窗口下培养。在培养附着藻类时,容器可静止不动;而培养浮游藻类时,应该每天摇动一次。
有的藻类在普通培养液中完全不能繁殖,有的繁殖非常困难。此时需改变培养液浓度,加入葡萄糖、蛋白胨等有机物,补充微量元素和辅助生长物质,加入土壤抽出液,就有可能获较好效果。
土壤抽出液制作方法:先在试管底部,加入高约1cm土壤(采用腐殖化的农田和庭院土)。再加入水使达5cm,塞上棉塞,采用蒸气间隙灭菌,每天灭菌1小时,连续二天。由于气泡上升,棉塞可能弄脏。因此,最好先在水中煮一段时间,使气泡跑掉后,再加棉塞进行灭菌。
(2)分离方法:常用下列四种。
1)微吸管(毛细管)分离 选直径较细(约5毫米)玻管,在火焰上加热,待快熔时,快速拉成口径极细的微吸管。将稀释适度藻液水样,置浅凹载玻片上,镜检。用微吸管挑选要分离的藻体,认真仔细地吸出,放入另一浅凹载片上,镜检这一滴水中是否达到纯分离的目的。如不成功,应反复几次,直至达到分离目的为止。然后移入经灭菌的培养液中培养,一般在每个培养皿中接20~30个个体。从分离出少量细胞扩大培养到200毫升的培养量,如硅藻一般需20天以上。为了较长时期保存藻种,可将分离到的藻种用青霉素(1000~5000单位或链霉素(20ppm)处理后,获得较纯藻种。
此法操作技术要求高,要细心。往往吸取一个细胞,要反复几次才能成功,且适于分离个体较大藻类。
2)水滴分离法 用微吸管吸取稀释适度藻液,滴到消毒过载片上,水滴尽可能滴小些,要求在低倍镜视野中能看到水滴全部或大部分。一个载片上滴2~4滴,间隔一定距离,作直线排列。如一滴水中只有几个所需同种藻类个体,无其他生物混杂,即用吸管吸取培养液,把这滴水冲入装有培养液并经灭菌试管或小三角瓶中去。如未成功,需反复重做,直到达到目的。
此法简便易行,尤其适宜于分离已在培养液中占优势种类。分离受少量生物污染培养液中的藻类多用此法。操作时同样要求细致、认真,使用工具及培养液经严格消毒。
3)稀释分离法 把含有需要分离的藻类而又混杂有其他生物的水样,取其一定量,用培养液稀释。通过稀释到适宜程度的方法,达到把原混杂生物单个分离培养的目的。
首先把水样稀释到每一滴含有一个左右的生物细胞(也可能一个都没有,也可能有两个),在稀释过程中配合显微镜检查,调节稀释度,然后准备装有1/4容量培养液的试管20支,每一试管加入稀释适宜水样一滴,摇匀,进行培养。待藻类生长繁殖达一定浓度时,再检查是否达到分离目的,若未达到,再重复做。
此法操作简单易行,但有一定程度盲目性,比不上水滴分离法效果好。
4)平板分离法 这个方法的培养基制备和分离方法,与菌类的平板分离法基本相同,只是培养基配方不同。也可将稀释藻液装入消毒过的小型喷雾器中(可使用医用喉头喷雾器),打开培养皿盖,把藻液喷射在培养基平面上,形成分布均匀的薄层水珠。
接种后,盖上盖,放在适宜的光、温条件下培养。一般经过十余天,就可在培养基上发生互相隔离的藻类群落,通过显微镜检查,寻找需要的纯藻群落,然后用消毒过的接种环移植到另一平板培养基培养,也可直接移植到装有培养液并经过灭菌的试管或小三角烧瓶中,加消毒棉花塞子,进行培养。
此法较繁,但难度不大,而且可看到是否污染杂菌,对于分离已污染杂菌培养液的藻类更合适。
5)底栖藻的分离 在显微镜或放大镜下挑取个体,一般可接种在固体培养基平板上,反复挑选、培养。
6)分离浮游蓝藻 可利用其浮力大,易浮起在水面的特性;分离硅藻则可利用其易沉淀的特性。
用以上各种方法分离到藻种,需放在适宜光照条件下(靠南或北窗口附近光线充足处,但严防阳光直射)培养,有条件的可控制温度和利用人工光源。培养时,每天轻轻摇动1~2次,但需注意勿把培养液沾湿棉塞,避免杂菌污染。经一段时间后,培养物颜色逐渐变深。再经一次显微镜检查,如无其他混杂生物,才达到单种培养目的。
2.藻种的培养
获得单种培养后,一方面扩大培养,另一方面可把藻种作较长时间保存,需要时随时取出使用。藻种培养要求比较严格,培养容器可用各种不同大小的三角烧瓶,容量有100、300、500、1000毫升,适于逐渐扩大培养。培养容器和工具需经煮沸灭菌或使用化学药品灭菌后,用煮沸水冲洗,培养液用加热灭菌法灭菌。按种后瓶口用灭菌纸包扎,放在适宜光、温条件下培养,每天轻轻摇动二次。大约二周后进行一次移植。藻种在培养过程中必须定期用显微镜检查,保持不受其他生物污染。
3.藻种的保藏
可接在固体培养基上,在常温、弱光下保藏半年到一年;也可在低温下(冰箱内)保藏,每天接受短时间(几个小时)弱光,可保藏2~3年;如不照光,只能保藏几个月。保藏藻种所用培养基的营养成分浓度应比正常培养基高一些,一般可增加一倍,琼脂量为1~1.5%。也可在固体培养基上,再加培养液,然后接种到培养液中,可以避免固体培养基干涸,保藏效果比单用固体好。
4.培养液和培养基的配方
配方极多,每种配方主要适用于一定藻种,这里介绍比较常用的几种:
水生4号和克诺普(Knop)培养液,一般用于绿藻;蓝藻可用朱氏10号或水生105号无氮培养基(后者适于固氮蓝藻);硅藻可用朱氏10号和水生硅1号培养基;另外还有海产绿藻、硅藻的培养基。常用培养基配方见表1。
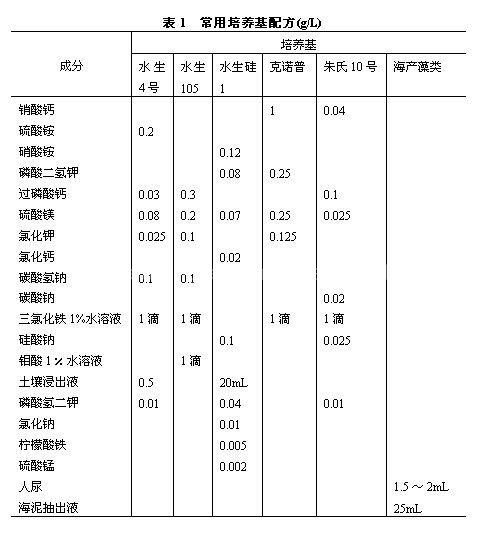
以上用水量都是加至1000mL,海藻培养液用海水,如无海水可用淡水1000mL加30克食盐代替。土壤抽出液用菜园土1份和水2份比例混合搅匀,静置,取上清液;海泥抽出液也可用同样比例制备。如配制固体培养基,可在培养液内加入1.5%琼脂。
从以上各种配方,可看到配制藻类培养液的几条原则:
(1)要有适量氮源(除固氮蓝藻外),如氨盐、硝酸盐、有机氮等。
(2)应包括主要元素钾、磷、镁、硫、钙等。
(3)要考虑各种盐类总浓度和pH是否适合藻类需要,可用碳酸氢钠调节pH。
(4)要加入各种藻类需要的微量元素,如铁、锰、铜、锌等(后几种包括在土壤抽出液中)。
(5)要满足某些藻类特殊需要,如蓝藻需钼,硅藻需硅。
(6)要添加适量生长物质如维生索B1、B2等(包括在土壤抽出液中)。
5.大量培养过程
包拈接种、培养、采收等。
(1)接种:一般要求选取生活力强、生长旺盛藻种。可先将浓缩藻种用连续稀释法,制备一定浓度的悬浮藻液,然后接入培养容器。接种时注意藻种和培养液比例要适当,使藻细胞在新培养液中达到一定数量。使一开始培养,藻类在培养液中占优势,另一方面还可缩短培养周期,这是培养得到成功的经验之一。在环境条件不很适合情况下,更需提高接种量。一般所用藻种浓度,根据藻类体积大小,每毫升30万~300万个,采用1∶2~1∶5的比例。还需注意接种时间,在自然光条件下,最好在上午8~10时,不宜在晚上。尤其是能运动种类,此时明显向上浮游,接种时可把上浮优质藻类吸出做藻种,起选种作用。
(2)培养管理:主要是使已接种培养物在相对稳定适宜环境中大量繁殖生长。要注意以下因素:
1)二氧化碳浓度在开放式不通气方法培养中,搅拌是十分必要的,可以增加水和空气的接触面,使空气中二氧化碳溶解到培养液中,而且帮助沉淀藻类细胞上浮获得光照。在通气培养中,培养液内应维持二氧化碳浓度在0.1~5%之间。
2)光照强度 利用太阳光源培养时,一般在室内培养可放在近窗口地方,防止强直射光照射。或利用人工光源(60~100瓦电灯或日光灯),需1500~3000勒克斯/厘米2。
3)温度 适温一般在10~30℃之间,最适温常为20~25℃。若在室外培养,夏季中午高温,冬季早晚低温,常造成不利影响,需设法调节。
4)无机营养 应不断添加新鲜培养液,及时补充被藻吸收后减少了的某些元素。
5)注意pH变化 如变动过大,可用酸、碱调节。
6)适当控制培养物中藻细胞浓度 过高会引起光照和无机营养不足,并导致pH上升。一般控制在0.3g(干重)/L范围内。
7)及时观察和检查藻类生长情况 可以通过培养物呈现的颜色、藻类细胞运动情况、是否有沉淀附壁、菌膜及敌害生物污染迹象等观察而了解一般的生长情况。藻种和中继培养每半月进行一次全面显微镜检查。大量培养中发现有不正常现象,应立即镜检,目的有两个:了解藻细胞生长情况,并检查有无敌害生物污染。
(3)采收:培养液中藻体的适时采收,既是培养的目的,也是继续培养的手段。因为通过采收一部分藻体,可使藻细胞浓度保持恒定。通常在培养物细胞浓度达到干重0.4~0.5克/升时,即可采收培养总量1/3的藻体。
采收时,先搅拌培养物,取出1/3量藻液,置于沉淀缸中,加入2%~3%明矾或6%饱和石灰水。约1~2小时,藻细胞即可完全沉淀,取出沉淀,离心、浓缩、烘干。在大型培养池中采收藻体,可另外设计适当的工艺流程。
