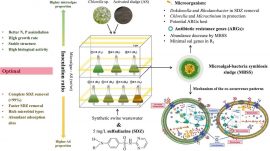
肠道菌群作为宿主健康的“隐形调节器”,其群落结构平衡与营养吸收、免疫稳态及代谢功能密切相关。当菌群失衡时,不仅会导致食物消化效率下降,更可能引发肠道炎症、免疫紊乱等连锁反应,成为代谢性疾病的潜在诱因。在寻找安全高效的肠道调节手段过程中,微藻因自身富含多糖、蛋白质、ω-3脂肪酸等多种活性物质,逐渐成为肠道健康领域的研究热点,被认为是极具潜力的营养干预来源。
本研究围绕微藻核心活性成分与肠道菌群的互作机制展开系统分析,揭示其多维度的肠道调控价值。作为微藻中研究最深入的活性成分,微藻多糖展现出明确的益生特性:它无法被人体上消化道直接分解,进入大肠后可作为“选择性益生元”,定向促进双歧杆菌、乳杆菌等有益菌的增殖,同时抑制沙门氏菌等致病菌的生长。有益菌代谢活性增强后,会大量产生短链脂肪酸(Short-chain fatty acids,SCFAs)——这种关键代谢产物不仅能为肠道上皮细胞供能,还可通过调节肠道pH值加固黏膜屏障,减少内毒素入血风险,从根源上改善肠道通透性。
微藻中的多酚类化合物与ω-3脂肪酸则从抗炎抗氧化维度为肠道健康保驾护航。多酚类物质通过清除肠道内过量活性氧,减轻氧化应激对肠黏膜的损伤;其抗炎机制则体现在抑制促炎细胞因子(如TNF-α、IL-6)的释放,调节免疫细胞活性,维持肠道免疫微环境稳定。而微藻来源的ω-3脂肪酸(如EPA、DHA)不仅能直接作用于肠道炎症通路,还可通过影响菌群代谢产物组成,间接增强肠道屏障功能,形成“活性成分-菌群-宿主”的协同调节网络。
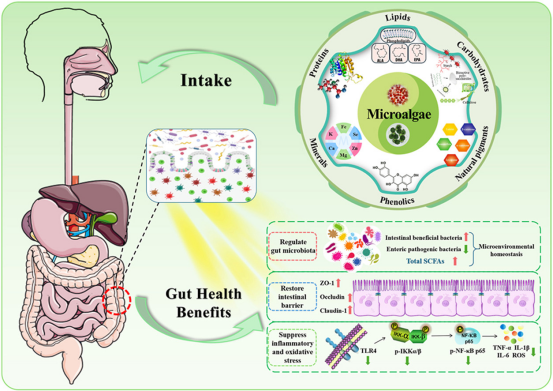
值得关注的是,微藻与益生菌的联用策略展现出显著的协同效应。微藻中的营养成分可为益生菌提供生长所需的碳源和能量,提升益生菌在肠道内的定植率和存活时间;而益生菌的代谢活动又能进一步转化微藻活性成分,增强其生物利用度。这种联用模式不仅放大了单一成分的肠道调节效果,更提升了菌群代谢活性的稳定性,为功能性食品开发提供了新方向。
本研究明确了微藻及其活性成分改善肠道健康的核心路径——以菌群平衡为切入点,通过增强屏障功能、缓解炎症反应实现双向调节。更重要的是,其调控作用已突破单一肠道系统,在肠-肝轴(减少肝损伤风险)、肠-脑轴(影响神经递质合成)等多轴网络中展现潜力,为微藻在慢性病预防、功能性营养领域的应用提供了坚实的理论支撑。
原文链接:Unraveling the potential of microalgae as nutrient sources for gut health enhancement: insights from the perspective of gut microbiota