当前,从深海鱼类获取EPA和DHA这两种对心脑血管和大脑健康至关重要的Omega-3脂肪酸,面临着资源可持续性的压力。微藻,作为一种环境友好的替代资源,展现出巨大潜力,其中普通小球藻便是一个研究焦点。为了大幅提升小球藻合成EPA和DHA的能力,我们的研究团队成功运用了一套结合化学诱变与适应性进化的“强化训练”策略。
我们首先使用一种名为甲基磺酸乙酯的化学诱变剂处理小球藻,并通过碘蒸气筛选法,成功找到了一株名为M41的“淀粉缺陷型”突变藻株。这株突变藻的特点是自身储存淀粉的能力变弱。随后,我们对M41进行了长期的“适应性实验室进化”培养,即在以乙酸为主要碳源的环境中不断传代,迫使它优化对乙酸的利用效率,从而更好地生长和积累目标产物。
实验结果非常显著。在补充乙酸的培养条件下,M41突变株展现出惊人的生长和合成能力: 生长优势:其细胞密度比原来提高了93.75%,收获的藻粉干重也增加了33%。
光合系统增强:负责光合作用的叶绿素a、叶绿素b和类胡萝卜素含量均实现翻倍增长,意味着其生命活动更为活跃。
核心目标达成:最关键的突破在于,M41菌株生产的EPA和DHA含量与普通野生小球藻相比,分别飙升了485%和161%,实现了数倍的增长。
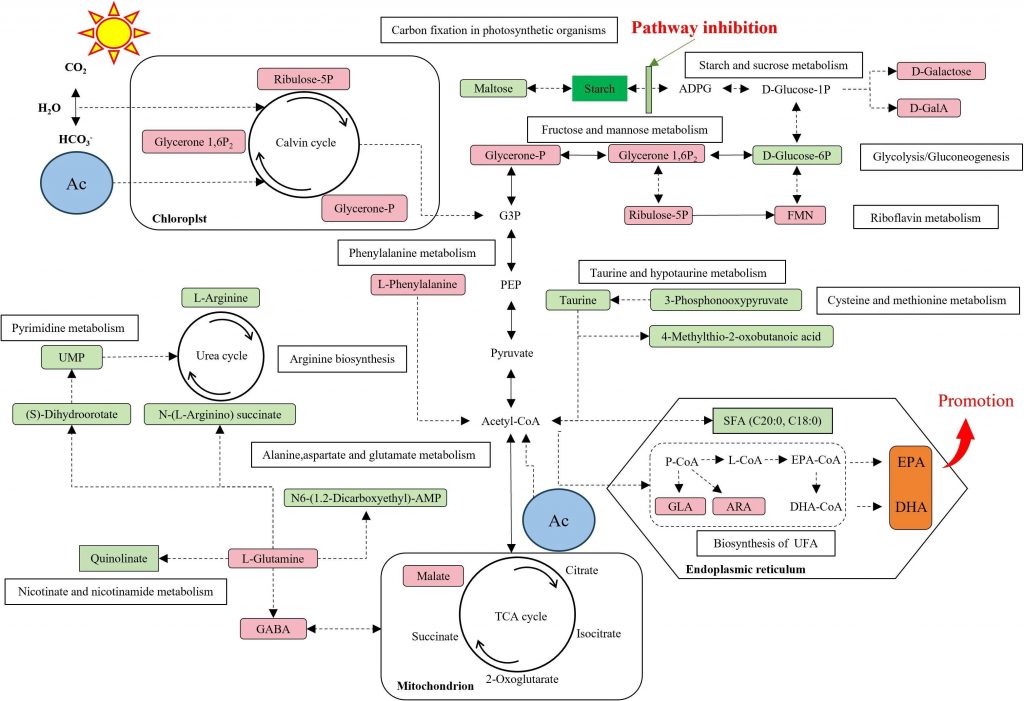
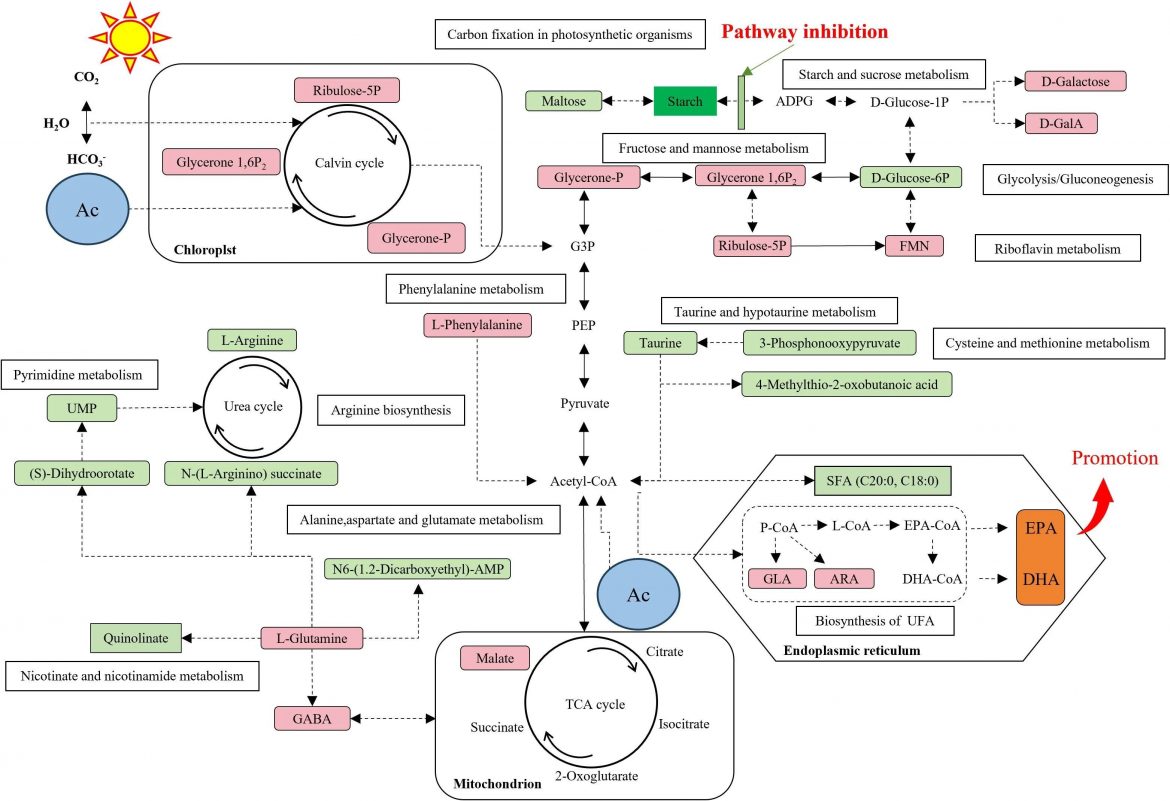
为了探究背后的原因,我们深入分析了M41的代谢网络,发现其内部发生了根本性的“代谢重塑”。简单来说,它的代谢路径发生了转向:合成饱和脂肪酸的路径受到抑制,而将更多的资源和“精力”用于生产单不饱和与多不饱和脂肪酸,特别是EPA和DHA。这其中,一个名为“γ-氨基丁酸支路”的代谢通道起到了关键作用,它能将原本用于合成蛋白质的碳源,巧妙地引导至脂质合成的路径上。此外,研究还发现,乙酸可能通过激活卡尔文循环,促进了二氧化碳的固定,从而为脂肪酸合成提供了更充足的“碳骨架”原料。 这项研究通过创新的联合育种策略,成功改造了小球藻的代谢系统,使其成为生产高价值EPA和DHA的高效“细胞工厂”。这不仅为Omega-3脂肪酸的可持续生产开辟了新路径,也为微藻在营养保健品、药品乃至生物能源等领域的规模化商业应用奠定了坚实的理论基础。
原文链接:Enhancing EPA and DHA synthesis in acetic acid-supplemented Chlorella vulgaris: A combined strategy of chemical mutagenesis and adaptive laboratory evolution