1 型糖尿病(T1D)的核心治疗需求是重建血糖调控的胰岛素分泌功能,基于生物材料的封装胰岛或 β 细胞植入物被视为理想方案。然而,免疫细胞浸润引发的自身免疫攻击、移植物周围纤维化形成以及局部缺氧微环境,三者共同导致 β 细胞存活期短,严重限制了该类植入物的临床应用转化。程序性死亡配体 – 1(PD-L1)具备诱导 T 细胞耗竭的独特功能,可为 β 细胞构建免疫保护屏障,抵御自身免疫攻击,为解决这一难题提供了关键靶点。
本研究创新性地设计了一种复合海藻酸水凝胶植入物,核心组件包括过表达 PD-L1 的 β 细胞微球(PD-L1 β-MCSs)与小球藻,构建成 PD-L1-β 细胞微球人工胰腺(PD-L1-β-MCSs aPancreas),旨在实现 T1D 高血糖的长效精准控制。体外实验证实,该系统展现出双重核心功能:一方面,PD-L1-β 细胞分泌的外泌体可高效诱导 T 细胞耗竭,同时将具有促炎特性的巨噬细胞极化为抗炎修复表型(M2 型),从源头抑制免疫攻击和炎症反应;另一方面,PD-L1 β-MCSs 保留了 β 细胞的葡萄糖敏感性,能够根据环境葡萄糖浓度变化规律性分泌胰岛素,实现血糖依赖性的精准调控。
体内移植实验进一步验证了该人工胰腺的治疗效能。移植后,PD-L1-β-MCSs aPancreas 可快速且显著缓解 T1D 模型小鼠的高血糖状态,其关键机制在于 PD-L1 介导的免疫调节作用:有效减少移植部位 CD4+ T 细胞、CD8+ T 细胞的浸润,降低促炎因子释放,同时抑制 M1 型巨噬细胞富集,显著减轻移植物周围的炎症反应和纤维化沉积,为 β 细胞存活创造了稳定的局部微环境。
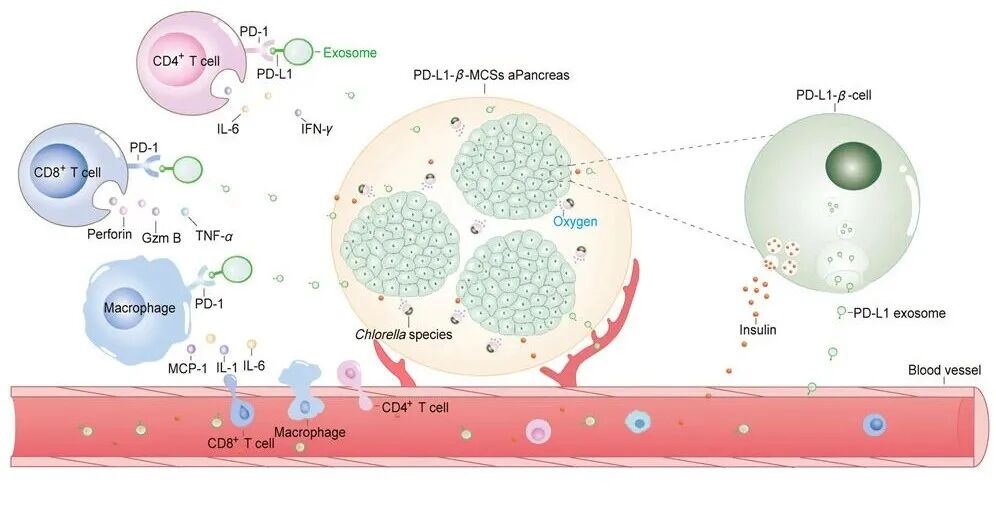
尤为重要的是,小球藻的引入解决了长期困扰细胞植入物的缺氧问题。小球藻通过光合作用持续产生氧气,直接缓解移植部位的局部缺氧,改善 β 细胞的代谢微环境,避免缺氧导致的细胞功能衰退和死亡。这种 “氧气补充 + 免疫调节” 的双重作用机制,使得接受移植的小鼠实现了血糖的长期稳定正常,显著延长了移植物的有效功能周期,突破了传统封装植入物存活期短的核心瓶颈。
该研究通过 PD-L1 介导的免疫保护、β 细胞的葡萄糖响应性胰岛素分泌以及小球藻的氧合作用三者协同,为 T1D 治疗提供了兼具免疫兼容、功能精准和长效稳定特性的新型植入物方案,为推动细胞替代疗法在 T1D 治疗中的临床应用奠定了重要基础。
原文链接:Artificial pancreas with engineered β cell microspheres overexpressing PD-L1 and algae ameliorate type 1 diabetes